DAFTAR ISI
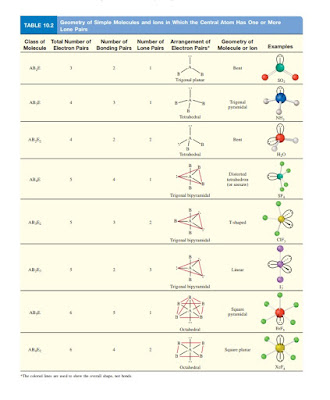
10.1. Geometri Molekular [kembali]
Geometri molekuler adalah susunan atom tiga dimensi dalam suatu molekul. SEBUAH geometri molekul mempengaruhi sifat fisik dan kimianya, seperti titik leleh, titik didih, kerapatan, dan jenis reaksi yang dialaminya. Secara umum, panjang ikatan dan sudut ikatan harus ditentukan dengan eksperimen. Namun, ada prosedur sederhana yang memungkinkan kita untuk memprediksi dengan cukup sukses, keseluruhan geometri a molekul atau ion jika kita mengetahui jumlah elektron yang mengelilingi atom pusat di dalamnya Struktur lewis. Dasar dari pendekatan ini adalah asumsi bahwa pasangan elektron dalam cangkang valensi atom saling tolak. Cangkang valensi adalah elektron terluar yang diduduki cangkang atom; itu memegang elektron yang biasanya terlibat dalam ikatan. Dalam ikatan kovalen, sepasang elektron, yang sering disebut pasangan ikatan, bertanggung jawab atas menyatukan dua atom. Namun, dalam molekul poliatomik, di mana ada dua atau lebih banyak ikatan antara atom pusat dan atom-atom sekitarnya, tolakan antara elektron dalam pasangan ikatan yang berbeda menyebabkan mereka tetap terpisah sejauh mungkin. Geometri yang akhirnya diasumsikan oleh molekul (sebagaimana ditentukan oleh posisi dari semua atom) meminimalkan tolakan. Pendekatan ini untuk studi molekuler geometri disebut model valensi-shell electron-pair repulsion (VSEPR), karena itu menyumbang pengaturan geometris pasangan elektron di sekitar pusat atom dalam hal tolakan elektrostatik antara pasangan elektron.
Dua aturan umum mengatur penggunaan model VSEPR:
1. Sejauh yang berkaitan dengan tolakan pasangan elektron, ikatan rangkap dan ikatan rangkap dapat diperlakukan seperti ikatan tunggal. Perkiraan ini baik untuk tujuan kualitatif. Namun, Anda harus menyadari bahwa pada kenyataannya banyak ikatan "lebih besar" daripada tunggal obligasi; yaitu, karena ada dua atau tiga ikatan antara dua atom, yang kerapatan elektron menempati lebih banyak ruang.
2. Jika sebuah molekul memiliki dua atau lebih struktur resonansi, kita dapat menerapkan VSEPR model untuk salah satu dari mereka. Biaya formal biasanya tidak ditampilkan. Dengan mengingat model ini, kita dapat memprediksi geometri molekul (dan ion) dalam a cara sistematis. Untuk tujuan ini, mudah untuk membagi molekul menjadi dua kategori, menurut apakah atom pusat memiliki pasangan elektron bebas atau tidak.
Molekul di mana Atom Pusat Tidak Memiliki Pasangan Sendiri Untuk kesederhanaan kami akan mempertimbangkan molekul yang mengandung atom hanya dari dua elemen, A dan B, di mana A adalah atom pusat. Molekul-molekul ini memiliki rumus umum ABx, dengan x adalah bilangan bulat 2, 3,. . . . (Jika x 5 1, kita memiliki molekul diatomik AB, yang linier dengan definisi.)
Hidrogen florida adalah senyawa kovalen dengan ikatan polar. Ada pergeseran kerapatan elektron dari H ke F karena atom F lebih elektronegatif daripada atom H. Pergeseran kerapatan elektron disimbolkan dengan menempatkan panah silang di atas struktur Lewis untuk menunjukkan arah pergeseran. Sebagai contoh,
di mana d (delta) menunjukkan muatan parsial. Pemisahan muatan ini dapat dikonfigurasikan dalam bidang listrik (Gambar 10.3). Ketika medan dihidupkan, molekul HF mengarahkan ujung negatifnya ke arah pelat positif dan ujung positifnya ke arah pelat negatif. Penjajaran molekul ini dapat dideteksi secara eksperimental. Ukuran kuantitatif polaritas ikatan adalah momen dipolnya (m), yang merupakan produk dari muatan Q dan jarak r antara muatan:
µ = Q . r
Molekul diatomik yang mengandung atom unsur yang berbeda (misalnya, HCl, CO, dan NO) memiliki momen dipol dan disebut molekul polar. Molekul diatomik yang mengandung atom dari unsur yang sama (misalnya, H2, O2, dan F2) adalah contoh molekul nonpolar karena mereka tidak memiliki momen dipol. Untuk molekul yang terdiri dari tiga atau lebih atom, baik polaritas ikatan dan geometri molekul menentukan apakah ada momen dipol. Bahkan jika ikatan polar hadir, molekul tidak harus memiliki momen dipol. Karbon dioksida (CO2), misalnya, adalah molekul triatomik, jadi geometrinya linear atau bengkok:
Panah menunjukkan pergeseran densitas elektron dari atom karbon yang kurang elektronegatif ke atom oksigen yang lebih elektronegatif. Dalam setiap kasus, momen dipol dari seluruh molekul terdiri dari dua momen ikatan, yaitu momen dipol individu dalam ikatan CPO polar. Momen ikatan adalah kuantitas vektor, yang berarti memiliki momen dan arah. Momen dipol yang diukur sama dengan jumlah vektor momen ikatan. Dua momen ikatan dalam CO2 sama besarnya. Karena mereka menunjuk ke arah yang berlawanan dalam molekul CO2 linier, jumlah atau momen dipol yang dihasilkan akan nol. Di sisi lain, jika molekul CO2 tertekuk, momen ikatan sebagian akan saling memperkuat, sehingga molekul akan memiliki momen dipol.
10.3. Teori Ikatan Valensi [kembali]
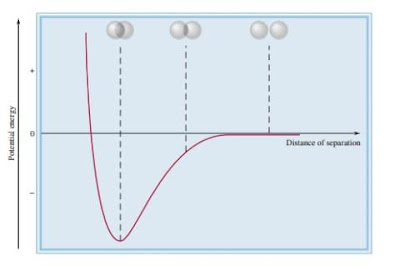
Model VSEPR, sebagian besar didasarkan pada struktur Lewis, menyediakan metode yang relatif sederhana dan mudah untuk memprediksi geometri molekul. Tetapi seperti yang kita catat sebelumnya, teori ikatan kimia Lewis tidak dengan jelas menjelaskan mengapa ikatan kimia itu ada. Saat ini, dua teori mekanika kuantum digunakan untuk menggambarkan pembentukan ikatan kovalen dan struktur elektronik molekul. Teori ikatan valensi (VB) mengasumsikan bahwa elektron dalam molekul menempati orbital atom masing-masing atom. Ini memungkinkan kita untuk mempertahankan gambar atom individu yang mengambil bagian dalam pembentukan ikatan. Teori kedua, disebut teori orbital molekul (MO), mengasumsikan pembentukan orbital molekul dari orbital atom. Tidak satu pun teori menjelaskan dengan sempurna semua aspek ikatan, tetapi masing-masing telah menyumbangkan sesuatu pada pemahaman kita tentang banyak sifat molekul yang diamati. Mari kita mulai diskusi kita tentang teori ikatan valensi dengan mempertimbangkan pembentukan molekul H2 dari dua atom H. Teori Lewis menggambarkan ikatan HOH dalam hal pasangan dari dua elektron pada atom H. Dalam kerangka teori ikatan valensi, ikatan HOH kovalen dibentuk oleh tumpang tindih dua orbital 1s dalam atom H. Dengan tumpang tindih, yang dimaksudkan adalah bahwa kedua orbital tersebut memiliki wilayah yang sama di ruang angkasa. Apa yang terjadi pada dua atom H ketika mereka bergerak ke arah satu sama lain dan membentuk ikatan? Awalnya, ketika kedua atom berjauhan, tidak ada interaksi. Kami mengatakan bahwa energi potensial dari sistem ini (yaitu, dua atom H) adalah nol. Ketika atom-atom saling mendekati, masing-masing elektron tertarik oleh inti atom lainnya; pada saat yang sama, elektron saling tolak, seperti halnya inti. Sementara atom masih terpisah, tarikan lebih kuat dari tolakan, sehingga energi potensial sistem berkurang (yaitu, menjadi negatif) ketika atom saling mendekati. Tren ini berlanjut hingga energi potensial mencapai nilai minimum. Pada titik ini, ketika sistem memiliki energi potensial terendah, ia paling stabil. Kondisi ini sesuai dengan tumpang tindih substansial orbital 1s dan pembentukan molekul H2 yang stabil. Jika jarak antara nuklei semakin menurun, energi potensial akan naik secara tajam dan akhirnya menjadi positif sebagai hasil dari peningkatan elektron-elektron dan tolakan nuklir-nuklir. Sesuai dengan hukum konservasi energi, penurunan energi potensial sebagai hasil dari pembentukan H2 harus disertai dengan pelepasan energi. Eksperimen ini menunjukkan itu sebagai molekul H2
Hibridisasi Orbital
Dalam kimia, hibridisasi adalah sebuah konsep bersatunya orbital-orbital atom membentuk orbital hibrid yang baru yang sesuai dengan penjelasan kualitatif sifat ikatan atom. Konsep orbital-orbital yang terhibridisasi sangatlah berguna dalam menjelaskan bentuk orbital molekul dari sebuah molekul. Konsep ini adalah bagian tak terpisahkan dari teori ikatan valensi. Walaupun kadang-kadang diajarkan bersamaan dengan teori VSEPR, teori ikatan valensi dan hibridisasi sebenarnya tidak ada hubungannya sama sekali dengan teori VSEPR.
Teori hibridisasi dipromosikan oleh kimiawan linus Pauling dalam menjelaskan struktur molekul seperti metana (CH4). Secara historis, konsep ini dikembangkan untuk sistem-sistem kimia yang sederhana, tetapi pendekatan ini selanjutnya diaplikasikan lebih luas, dan sekarang ini dianggap sebagai sebuah heuristik yang efektif untuk merasionalkan struktur senyawa organik.
Teori hibridisasi tidaklah sepraktis teori orbital molekul dalam hal perhitungan kuantitatif. Masalah-masalah pada hibridisasi terlihat jelas pada ikatan yang melibatkan orbital d, seperti yang terdapat pada kimia koordinasi . Walaupun skema hibridisasi pada logam transisi dapat digunakan, ia umumnya tidak akurat.
Sangatlah penting untuk dicatat bahwa orbital adalah sebuah model representasi dari tingkah laku elektron-elektron dalam molekul. Dalam kasus hibridisasi yang sederhana, pendekatan ini didasarkan pada orbital-orbital atom hidrogen. Orbital-orbital yang terhibridisasikan diasumsikan sebagai gabungan dari orbital-orbital atom yang bertumpang tindih satu sama lainnya dengan proporsi yang bervariasi. Orbital-orbital hidrogen digunakan sebagai dasar skema hibridisasi karena ia adalah salah satu dari sedikit orbital yang persamaam schordingernya memiliki penyelesaian analitis yang diketahui. Orbital-orbital ini kemudian diasumsikan terdistorsi sedikit untuk atom-atom yang lebih berat seperti karbon, nitrogen, dan oksigen. Dengan asumsi-asumsi ini, teori hibridisasi barulah dapat diaplikasikan. Perlu dicatat bahwa kita tidak memerlukan hibridisasi untuk menjelaskan molekul, tetapi untuk molekul-molekul yang terdiri dari karbon,nitrogen dan oksigen, teori hibridisasi menjadikan penjelasan strukturnya lebih mudah.
Teori hibridisasi sering digunakan dalam kimia organik, biasanya digunakan untuk menjelaskan molekul yang terdiri dari atom C, N, dan O (kadang kala juga P dan S). Penjelasannya dimulai dari bagaimana sebuah ikatan terorganisasikan dalam metana.
 sama dengan
sama dengan  Sebuah pandangan alternatifnya adalah dengan memandang karbon sebagai anion C4−. Dalam kasus ini, semua orbital karbon terisi:
Jika kita menrekombinasi orbital-orbital ini dengan orbital-s 4 hidrogen (4 proton, H+) dan mengijinkan pemisahan maksimum antara 4 hidrogen (yakni tetrahedal), maka kita bisa melihat bahwa pada setiap orientasi orbital-orbital p, sebuah hidrogen tunggal akan bertumpang tindih sebesar 25% dengan orbital-s C dan 75% dengan tiga orbital-p C. HaL ini sama dengan persentase relatif antara s dan p dari orbital hibrid sp3 (25% s dan 75% p).
Menurut teori hibridisasi orbital, elektron-elektron valensi metana seharusnya memiliki tingkat energi yang sama, tetapi spektrum fotoelektron nya menunjukkan bahwa terdapat dua pita, satu pada 12,7 eV (satu pasangan elektron) dan saty pada 23 eV (tiga pasangan elektron). Ketidakkonsistenan ini dapat dijelaskan apabila kita menganggap adanya penggabungan orbital tambahan yang terjadi ketika orbital-orbital sp3 bergabung dengan 4 orbital hidrogen.
Sebuah pandangan alternatifnya adalah dengan memandang karbon sebagai anion C4−. Dalam kasus ini, semua orbital karbon terisi:
Jika kita menrekombinasi orbital-orbital ini dengan orbital-s 4 hidrogen (4 proton, H+) dan mengijinkan pemisahan maksimum antara 4 hidrogen (yakni tetrahedal), maka kita bisa melihat bahwa pada setiap orientasi orbital-orbital p, sebuah hidrogen tunggal akan bertumpang tindih sebesar 25% dengan orbital-s C dan 75% dengan tiga orbital-p C. HaL ini sama dengan persentase relatif antara s dan p dari orbital hibrid sp3 (25% s dan 75% p).
Menurut teori hibridisasi orbital, elektron-elektron valensi metana seharusnya memiliki tingkat energi yang sama, tetapi spektrum fotoelektron nya menunjukkan bahwa terdapat dua pita, satu pada 12,7 eV (satu pasangan elektron) dan saty pada 23 eV (tiga pasangan elektron). Ketidakkonsistenan ini dapat dijelaskan apabila kita menganggap adanya penggabungan orbital tambahan yang terjadi ketika orbital-orbital sp3 bergabung dengan 4 orbital hidrogen.
Karbon akan melakukan hibridisasi sp2 karena orbtial-orbital hibrid hanya akan membentuk ikatan sigma dan satu ikatan pi seperti yang disyaratkan untuk ikatan rangkap 2 di antara karbon-karbon. Ikatan hidrogen-karbon memiliki panjang dan kuat ikat yang sama. Hal ini sesuai dengan data percobaan.
Dalam hibridisasi sp2, orbital 2s hanya bergabung dengan dua orbital 2p:
membentuk 3 orbital sp2 dengan satu orbital p tersisa. Dalam etilena, dua atom karbon membentuk sebuah ikatan sigma dengan bertumpang tindih dengan dua orbital sp2 karbon lainnya dan setiap karbon membentuk dua ikatan kovalen dengan hidrogen dengan tumpang tindih s-sp2 yang bersudut 120°. Ikatan pi antara atom karbon tegak lurus dengan bidang molekul dan dibentuk oleh tumpang tindih 2p-2p (namun, ikatan pi boleh terjadi maupun tidak). Jumlah huruf p tidaklah seperlunya terbatas pada bilangan bulat, yakni hibridisasi seperti sp2.5 juga dapat terjadi. Dalam kasus ini, geometri orbital terdistorsi dari yang seharusnya. Sebagai contoh, seperti yang dinyatakan dalam kaidah bent, sebuah ikatan cenderung untuk memiliki huruf-p yang lebih banyak ketika ditujukan ke substituen yang lebih elektronegatif
Dalam model ini, orbital 2s hanya bergabung dengan satu orbital-p, menghasilkan dua orbital sp dan menyisakan dua orbital p. Ikatan kimia dalam asetilena(etuna) terdiri dari tumpang tindih sp-sp antara dua atom karbon membentuk ikatan sigma, dan dua ikatan pi tambahan yang dibentuk oleh tumpang tindih p-p. Setiap karbon juga berikatan dengan hidrogen dengan tumpang tindih s-sp bersudut 180°.
Hibrid sp3
Hibridisasi menjelaskan atom-atom yang berikatan dari sudut pandang sebuah atom. Untuk sebuah karbon yang berkoordinasi secara tetrahedal (seperti metana, CH4), maka karbon haruslah memiliki orbital-orbital yang memiliki simetri yang tepat dengan 4 atom hidrogen. Konfigurasi keadaan dasar karbon adalah 1s2 2s2 2px1 2py1 atau lebih mudah dilihat: (Perhatikan bahwa orbital 1s memiliki energi lebih rendah dari orbital 2s, dan orbital 2s berenergi sedikit lebih rendah dari orbital-orbital 2p) Teori Ikatan Valensi memprediksikan, berdasarkan pada keberadaan dua orbital p yang terisi setengah, bahwa C akan membentuk dua ikatan kovalen, yaitu CH2. Namun, metilena adalah molekul yang sangat reaktif (lihat pula: karbena), sehingga teori ikatan valensi saja tidak cukup untuk menjelaskan keberadaan CH4. Lebih lanjut lagi, orbital-orbital keadaan dasar tidak bisa digunakan untuk berikatan dalam CH4. Walaupun eksitasi elektron 2s ke orbital 2p secara teori mengizinkan empat ikatan dan sesuai dengan teori ikatan valensi (adalah benar untuk O2), hal ini berarti akan ada beberapa ikatan CH4 yang memiliki energi ikat yang berbeda oleh karena perbedaan aras tumpang tindih orbital. Gagasan ini telah dibuktikan salah secara eksperimen, setiap hidrogen pada CH4 dapat dilepaskan dari karbon dengan energi yang sama. Untuk menjelaskan keberadaan molekul CH4 ini, maka teori hibridisasi digunakan. Langkah awal hibridisasi adalah eksitasi dari satu (atau lebih) elektron: Proton yang membentuk inti atom hidrogen akan menarik salah satu elektron valensi karbon. Hal ini menyebabkan eksitasi, memindahkan elektron 2s ke orbital 2p. Hal ini meningkatkan pengaruh inti atom terhadap elektron-elektron valensi dengan meningkatkan potensial inti efektif. Kombinasi gaya-gaya ini membentuk fungsi-fungsi matematika yang baru yang dikenal sebagai orbital hibrid. Dalam kasus atom karbon yang berikatan dengan empat hidrogen, orbital 2s (orbital inti hampir tidak pernah terlibat dalam ikatan) "bergabung" dengan tiga orbital 2p membentuk hibrid sp3 (dibaca s-p-tiga) menjadi Pada CH4, empat orbital hibrid sp3 bertumpang tindih dengan orbital 1s hidrogen, menghasilkan empat ikatan sigma. Empat ikatan ini memiliki panjang dan kuat ikat yang sama, sehingga sesuai dengan pengamatan. sama dengan
sama dengan  Sebuah pandangan alternatifnya adalah dengan memandang karbon sebagai anion C4−. Dalam kasus ini, semua orbital karbon terisi:
Jika kita menrekombinasi orbital-orbital ini dengan orbital-s 4 hidrogen (4 proton, H+) dan mengijinkan pemisahan maksimum antara 4 hidrogen (yakni tetrahedal), maka kita bisa melihat bahwa pada setiap orientasi orbital-orbital p, sebuah hidrogen tunggal akan bertumpang tindih sebesar 25% dengan orbital-s C dan 75% dengan tiga orbital-p C. HaL ini sama dengan persentase relatif antara s dan p dari orbital hibrid sp3 (25% s dan 75% p).
Menurut teori hibridisasi orbital, elektron-elektron valensi metana seharusnya memiliki tingkat energi yang sama, tetapi spektrum fotoelektron nya menunjukkan bahwa terdapat dua pita, satu pada 12,7 eV (satu pasangan elektron) dan saty pada 23 eV (tiga pasangan elektron). Ketidakkonsistenan ini dapat dijelaskan apabila kita menganggap adanya penggabungan orbital tambahan yang terjadi ketika orbital-orbital sp3 bergabung dengan 4 orbital hidrogen.
Sebuah pandangan alternatifnya adalah dengan memandang karbon sebagai anion C4−. Dalam kasus ini, semua orbital karbon terisi:
Jika kita menrekombinasi orbital-orbital ini dengan orbital-s 4 hidrogen (4 proton, H+) dan mengijinkan pemisahan maksimum antara 4 hidrogen (yakni tetrahedal), maka kita bisa melihat bahwa pada setiap orientasi orbital-orbital p, sebuah hidrogen tunggal akan bertumpang tindih sebesar 25% dengan orbital-s C dan 75% dengan tiga orbital-p C. HaL ini sama dengan persentase relatif antara s dan p dari orbital hibrid sp3 (25% s dan 75% p).
Menurut teori hibridisasi orbital, elektron-elektron valensi metana seharusnya memiliki tingkat energi yang sama, tetapi spektrum fotoelektron nya menunjukkan bahwa terdapat dua pita, satu pada 12,7 eV (satu pasangan elektron) dan saty pada 23 eV (tiga pasangan elektron). Ketidakkonsistenan ini dapat dijelaskan apabila kita menganggap adanya penggabungan orbital tambahan yang terjadi ketika orbital-orbital sp3 bergabung dengan 4 orbital hidrogen.
Hibrid sp2
Senyawa karbon ataupun molekul lainnya dapat dijelaskan seperti yang dijelaskan pada metana. Misalnya etilena (C2H4) yang memiliki ikatan rangkap dua di antara karbon-karbonnya. Struktur Kekule metilena akan tampak seperti:membentuk 3 orbital sp2 dengan satu orbital p tersisa. Dalam etilena, dua atom karbon membentuk sebuah ikatan sigma dengan bertumpang tindih dengan dua orbital sp2 karbon lainnya dan setiap karbon membentuk dua ikatan kovalen dengan hidrogen dengan tumpang tindih s-sp2 yang bersudut 120°. Ikatan pi antara atom karbon tegak lurus dengan bidang molekul dan dibentuk oleh tumpang tindih 2p-2p (namun, ikatan pi boleh terjadi maupun tidak). Jumlah huruf p tidaklah seperlunya terbatas pada bilangan bulat, yakni hibridisasi seperti sp2.5 juga dapat terjadi. Dalam kasus ini, geometri orbital terdistorsi dari yang seharusnya. Sebagai contoh, seperti yang dinyatakan dalam kaidah bent, sebuah ikatan cenderung untuk memiliki huruf-p yang lebih banyak ketika ditujukan ke substituen yang lebih elektronegatif
Hibrid sp
Ikatan kimia dalam senyawa seperti alkuna dengan ikatan rangkap tiga dijelaskan dengan hibridisasi sp.Dalam model ini, orbital 2s hanya bergabung dengan satu orbital-p, menghasilkan dua orbital sp dan menyisakan dua orbital p. Ikatan kimia dalam asetilena(etuna) terdiri dari tumpang tindih sp-sp antara dua atom karbon membentuk ikatan sigma, dan dua ikatan pi tambahan yang dibentuk oleh tumpang tindih p-p. Setiap karbon juga berikatan dengan hidrogen dengan tumpang tindih s-sp bersudut 180°.

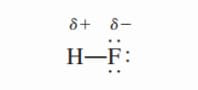










Tidak ada komentar:
Posting Komentar